【実験の概要】
ブタ膵臓エラスターゼとその阻害剤との複合体の中性子構造解析には、原子力機構が東海研究開発センター原子力科学研究所(茨城県東海村)の研究用原子炉(JRR-3)に設置した生体高分子用中性子回折計装置BIX-35)を用いました。得られたデータを解析することによって膵臓エラスターゼの全原子構造(図1)を観測することに成功しました。
タンパク質分解酵素(プロテアーゼ)はタンパク質のペプチド結合を加水分解する酵素で、生体内では栄養吸収、タンパク質の廃棄とリサイクル、生体防御などの役割を果たしています。タンパク質分解酵素の1つであるセリンプロテアーゼ1)は、セリンというアミノ酸をハサミとして使いペプチド結合を切断しますが、その切断反応過程においてオキシアニオン(酸素陰イオン)ホール2)と呼ばれる特徴的な構造が重要な役割を果たすと考えられています。オキシアニオンホールはセリンプロテアーゼが有する高い加水分解活性の発現に必要不可欠ですが、実際にオキシアニオンホールがどのように酸素原子を見分けているのかはこれまで明らかになっていませんでした。その解明には水素原子の情報を含むセリンプロテアーゼの全原子構造情報を得る必要がありますが、タンパク質の主要構成元素の一つである水素原子の観測は大変難しいことが知られています。そこで、研究グループは、セリンプロテアーゼの1種であり、立体構造を基盤とした創薬研究の代表的な題材として用いられてきたエラスターゼ3)とその阻害剤(医薬品の候補となる化合物)との結晶構造を、中性子を用いてはじめて解析(中性子構造解析4))に成功しました。
セリンプロテアーゼは、ヒスチジン(His57)、アスパラギン酸(Asp102)およびセリン(Ser195)の3つのアミノ酸を触媒残基として保持しており、そのうちSer195がハサミの役割を果たします。セリンプロテアーゼの非常に高いタンパク質分解活性は、「His57とAsp102の間に強い水素結合が形成されること」及び「Ser195近傍の特徴的な立体構造(オキシアニオンホール)において、分解物が酸素陰イオンを生成すること」が重要であると考えられています。これまでに数多くのセリンプロテアーゼの立体構造がX線結晶構造解析により報告されていますが、X線は水素原子の検出に対して感度が低いため、前者についてはさまざまな説が唱えられており、後者については直接的に観測された例はありませんでした。そこで研究グループは、セリンプロテアーゼとしてブタ膵臓エラスターゼを研究対象に選び、水素(重水素)原子の検出に対して感度の高い中性子を用いて立体構造解析を実施し、これらの問題の解決に臨みました。
ブタ膵臓エラスターゼとその阻害剤との複合体の中性子構造解析には、原子力機構が東海研究開発センター原子力科学研究所(茨城県東海村)の研究用原子炉(JRR-3)に設置した生体高分子用中性子回折計装置BIX-35)を用いました。得られたデータを解析することによって膵臓エラスターゼの全原子構造(図1)を観測することに成功しました。

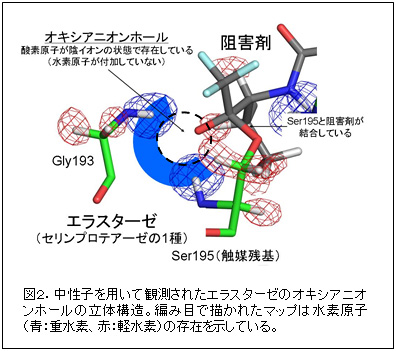
今回用いた阻害剤は、エラスターゼが本来その機能を果たす対象であるペプチドを模倣した立体構造を持つことでエラスターゼに結合し、さらに触媒残基であるSer195と直接化学結合を形成することによって酵素反応の途中(反応中間体)で反応が停止し、エラスターゼの機能を止めるように設計されています。この複合体の立体構造解析の結果、図2に示すようにSer195と2つ隣のグリシン(Gly193)の主鎖のアミド基の水素原子の存在が中性子から明らかになり(青の編み目)、図中の破線の場所にオキシアニオンホールが形成されていることがわかりました。さらに、オキシアニオンホールには阻害剤に由来する酸素原子が存在していますが、酸素原子に付加した水素原子は確認できず、酸素陰イオンの状態であることを世界で初めて確認することに成功しました。
また、His57とAsp102の間に形成された水素結合は結合距離が大変短く、とても強い水素結合であると判明したものの、水素原子はHis57に結合しており、一説として唱えられている低障壁水素結合の特徴(水素原子がドナーとアクセプターの中間付近に存在する)は満たされていませんでした。したがって今回の研究結果は、低障壁水素結合仮説を否定するものでした。
なお、今回の解析では、試料の水素原子の一部を重水素原子に置き換えて測定しました。重水素原子は水素原子の安定同位体の一つであり、化学的な性質は水素原子と比較してよく似ています。図2に示す2つのマップは重水素原子の観察結果であり、青が軽水素原子と置き換わった重水素原子、赤が水素原子の存在を示しています。
本研究で得られたエラスターゼと阻害剤の全原子構造情報は、セリンプロテアーゼに共通する触媒メカニズムの解明に繋がります。また阻害剤との詳細な相互作用様式に関する知見は、さらに高活性の阻害剤の開発に繋がるものと期待されます。
本研究は、原子力機構及び大阪府立大学の2機関が共同して実施しました。原子力機構は主に膵臓エラスターゼの中性子を用いた構造解析を、大阪府立大学は中性子回折実験用の大型結晶作製を担当しました。