【研究開発の背景と目的】
♦ 背景:
99Moの娘核種5) 99mTcを含む医薬品は、核医学診断用RIとして最も多用され、世界中で年間3000万件、我が国でも年間70万~90万件の診断が、海外から輸入した99Moを用いて行われています。
現在、世界が必要とする半減期66時間の99Moの95%以上は、世界の5基の高経年化した研究用原子炉で、高濃縮235Uによる核分裂反応により製造されています。しかし、最近、海外のRI製造を行っている研究用原子炉が、長期に計画外停止になるなど、99Moを含む短半減期RIの確保が困難になりつつあることから、医療用RIを中長期にわたり安定に確保する製造法の確立は、日本のみならず世界中の喫緊の課題になっています。
♦ 目的:
99Moの国内供給安定化に資するとともに、原子炉を有しない海外への本方式の展開を図るため。
【研究の手法】
♦ 99Mo生成:
加速器からの重陽子ビームを炭素等の中性子生成用標的に照射して高速中性子を生成します。この中性子を三酸化モリブデン100 (100MoO3)に照射して、2個の中性子(n)を取出す原子核反応、100Mo + n → 99Mo + 2n{以後、(n,2n)と略記}で99Moを生成します(図1参照)。
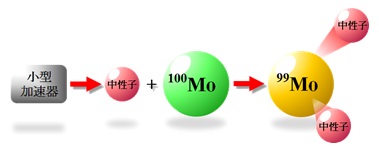
図1 100Moに加速器からの中性子(n)を照射して、2個の中性子を放出して99Moを生成
加速器中性子を、100Moに照射した時に生成される色々な生成物に対する反応断面積を図2に示します。この図から、次の重要な事実がわかります。
i) 99Moを生成する(n,2n)反応断面積は、中性子のエネルギーが10~18 MeVの領域で、全ての反応中最大であり、14 MeV程度の高速中性子が99Moの生成に有効です。
ii) 不要なRIを生成する反応{(n,3n)、(n,p)、(n,4He)}の断面積は、中性子エネルギーが14 MeV付近では、(n,2n)の1/500以下であるため、不必要な放射性物質の生成を最小限に抑えつつ、99Moから99mTcを分離抽出することが可能です。
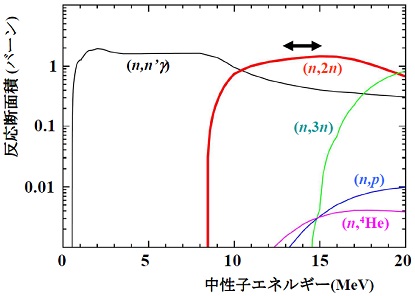
図2 100Moに中性子を照射した際に起こる全ての原子核反応の断面積。(n,2n)反応断面積が10~18MeVで大きな値を持ちます。なお、(n,n’)は非弾性散乱反応で放射性物質は生成しません。(n,3n)、(n,p)及び(n,4He)反応では、98Mo(安定)、100Nb(半減期3秒)及び97Zr(半減期16.9時間)が生成されます。
♦ 99Moを製造する方法:
原子力機構の原子力科学研究所(東海村)にある核融合中性子源施設(FNS: Fusion Neutronics Source)や高崎量子応用研究所(高崎市)にあるイオン照射研究施設(TIARA: Takasaki Ion Accelerators for Advanced Radiation Application)の加速器で生成される中性子をMoO3試料に照射して99Moを生成します。
♦ 99Moから高純度の99mTcを分離して抽出する方法:
99Moから99mTcの分離は、固体の酸化モリブデン(MoO3)と酸化テクネチウム(Tc2O7)が気体になる時の昇華温度が、795度と310度と大きく異なることを利用して行います。加速器で照射した99Moを含む試料を電気炉(図3)に封入して、温度を上げて99mTcを分離抽出します。
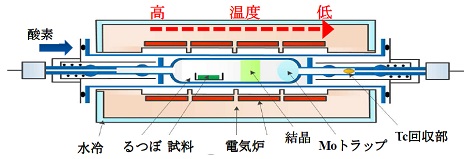
図3 電気炉に内挿した石英管中の試料部からTc回収部に向かって、温度勾配(高→低)を作り、99mTcを分離回収します。
【得られた成果】
1) 熱分離法による99mTcの高効率分離に成功
加速器で照射した99Moを含む試料(MoO3)を電気炉に封入して、温度をMoO3の融点(795℃)以上に上げて99mTcを気化させ、酸素ガスを流しながら、温度が低いTc回収部に99mTcを導きます。温度、キャリアガスの種類(酸素、空気)等の熱分離条件を検討した結果、80%以上の高収率で、99mTcをターゲットであるMoO3から分離することに成功しました。図4に、ターゲット位置での99mTcの量(γ線測定)の変化の一例を示します。1時間以内で、80-90%の99mTcがターゲットから分離されていることがわかります。さらに、1日1回の分離を4回続けても、高い分離収率を維持しています。これらの結果、我々は、熱分離法によって99mTcを分離する際の長年の課題を解決しました。
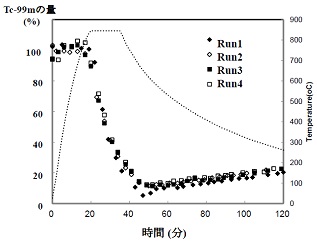
図4 MoO3中の99mTcの量の時間変化(99mTcの141 keVのγ線を測定)
2) 99mTcの高純度回収に成功
次に、熱分離法により分離した99mTcを水酸化ナトリウムに溶解し、吸着材として物質の分離に利用されるアルミニウム酸化物(Al2O3)を円筒状の容器に詰めたものに、99mTc溶液を通液、99mTcを吸着させ、その後、生理食塩水を流して回収しました。
回収した99mTc溶液中の純度を調べるため、不純物放射性同位体の定量(放射性核種的純度)、99mTcの化学形測定(放射化学的純度)及び不純物元素(アルミニウム)の定量を行いました。その結果、表1に示すように、高純度であることを確認し、放射性医薬品に関する基準を満たしていることを明らかにしました。
表1 99mTc最終溶液の純度試験
| 試験内容 | 試験結果 | 放射性医薬品に関する基準 |
|---|---|---|
| 不純物RI(99Mo, 97Zr, 97Nb)の含有量 | 検出されず 【不純物RIの全放射能量: 99mTcの0.01%以下】 | 99Mo: 99mTcの0.015%以下 |
| 放射化学的異物試験 | ろ紙クロマトグラフ法による分析の結果99%以上が過テクネチウム酸ナトリウム | 95%以上 |
| アルミニウム含量 | 0.07~0.27 ppm | 10ppm以下 |
3)加速器中性子で生成した99Moから精製した99mTcの医薬品への標識化に成功
骨疾患及び心臓疾患の診断に利用される医薬品(テクネMDPキット及びカーディオライト第一、富士フイルムRIファーマ製)に、上記熱分離法で抽出回収した99mTcを標識した結果、ともに99%以上の高い標識率で標識化に成功しました。
4)加速器中性子製99mTcを用いて合成した99mTc放射性医薬品のマウス生体内分布画像の撮影
(n,2n)99Moから熱分離・精製した99mTcを富士フイルムRIファーマ株式会社へ供給し、骨診断用医薬品(MDP)を用いたマウス生体内分布画像を初めて取得しました。図5に、SPECT-CT画像を示します。その結果、(n,2n)99Mo製99mTcを用いたMDP薬剤の骨への集積(図5(a))が確認され、市販のウランの核分裂で生成される(fission99Mo製)99mTc製品を用いた場合(図5(b))と同等であることを明らかにしました。
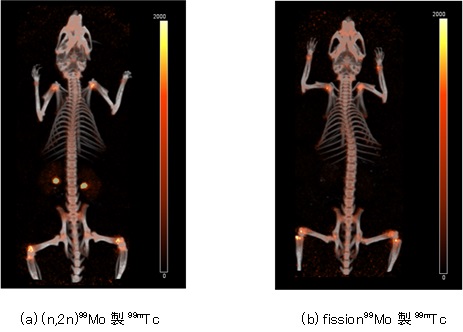
図5 99mTc-MDP薬剤のSPECT-CTによるマウス生体内分布画像
(a)においては、腎臓への集積が認められますが、これは、99mTc-MDPが代謝され、腎臓から尿として排出される過程が観察されています。
【今後の予定】
1) 熱分離した99mTcを溶液として回収する方法の最適化を行います。
2) 実用規模の大量の99mTcを熱分離法で得るために、100グラム以上のMoO3から分離する装置の開発を行います。そのために、照射済みMoO3を収納するるつぼを多段式にした 縦型の熱分離装置を試作します。
3) 多量の99Moを加速器中性子で生成できる様に、照射時の熱除去を可能にする中性子 生成用炭素標的の試作・開発を行います。
4) 加速器中性子によるRI生成法は、99Moに限らず、がん治療に有用なイットリウム90、銅67等のRIを生成することが可能であり、多様なRI生成・分離の研究開発も、併せて進めます。