【背景】
自然環境を汚染しないクリーンなエネルギー社会実現への関心が高まる中、水素をエネルギー源として利用する試みが活発になっており、高性能な水素貯蔵材料の開発が急がれています。水素貯蔵材料に求められる性能は、軽量コンパクトで輸送が容易であり、かつ生活環境に近い圧力や温度条件で簡単に水素の貯蔵・放出ができることです。アルミニウム水素化物(α-AlH3)は、自然界に豊富にあるアルミニウム(注1)を原料とし、軽量でかつ水素を多量に貯蔵出来るため、有望な水素貯蔵材料と考えられています(図1)。しかしながら、水素の貯蔵・放出過程の制御には高圧・高温の条件が必要で、実用化には課題が残されています。水素の貯蔵・放出過程の制御のためには、水素がどのような結合様式により水素貯蔵材料に吸収されているのかについて正確な知見が不可欠ですが、アルミニウム水素化物における水素原子とアルミニウム原子の結合様式については、多くの理論的予測があるにも関わらず、イオン結合的か共有結合的なのかの決着がついていませんでした(図2)。そのため電子状態を実験的に調べることが強く望まれていました。
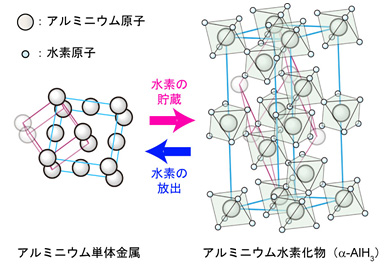
図1 アルミニウム単体金属(Al)とアルミニウム水素化物(α-AlH3)の結晶構造。水素の貯蔵・放出により構造が大きく変化します。アルミニウム単体金属は面心立方構造です。一方、アルミニウム水素化物においては、アルミニウム原子は頂点にある6個の水素原子に囲まれた8面体の構造になっています。そして、それぞれの水素原子は別の8面体の頂点になるような構造になります。
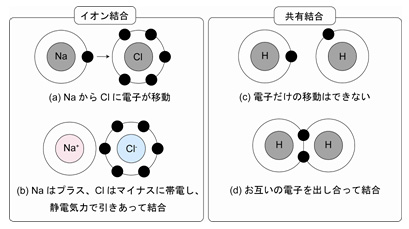
図2 イオン結合と共有結合のイメージ。イオン結合の典型例として食塩(NaCl)があります。(a)NaClではナトリウム原子よりも塩素原子の方が圧倒的に電子(●)を引き付けやすいために、ナトリウム原子の電子が塩素原子に一つ移動することにより、(b)塩素原子がマイナスの電気を帯び、ナトリウム原子がプラスの電気を帯びます。その結果、電気的な引力でお互いを引きつけ合って結合します。この結合様式のことをイオン結合と言います。一方、共有結合の典型例として水素ガス(H2)があります。(c)H2ではそれぞれの原子があと一つ電子を取り込むと非常に安定な状態になることができるので、(d)お互いの水素原子が電子を提供し合って結合します。この結合様式のことを共有結合と言います。
【研究成果の内容】
本研究では、アルミニウムが水素を貯蔵するとアルミニウムの電子状態がどのように変化するのかを調べ、水素原子とアルミニウム原子の結合様式を明らかにすることを目的としました。
大型放射光施設SPring-8(注2)の軟X線光化学ビームラインBL27SUにおいて、水素を含まないアルミニウム単体金属とアルミニウム水素化物に対して、放射光軟X線(注3)を用いた発光分光法(注4)と内殻吸収分光法(注5)により、それぞれの電子状態を調べました。これらの実験手法では、複数の元素が含まれた物質であっても特定の元素の特定の電子についての電子状態を抜き出して調べることができ、発光分光実験からは占有電子状態(注6)、内殻吸収分光実験からは非占有電子状態(注7)についての情報を得ることができます。そしてこれら二つの実験を組み合わせることで、結合様式を知るために必要な全電子状態を知ることができます。今回の実験では、アルミニウム原子が持っている電子の中で、主に水素原子との結合に関与するAl 3p電子状態に注目しました(図3)。
実験結果を図4に示します。青色がアルミニウム単体金属で赤色がアルミニウム水素化物の測定結果です。水素原子がアルミニウム単体金属に貯蔵されることで、電子状態に二つの明らかな変化が観測されました。矢印①で示すように、発光分光スペクトルの強度が増大することからAl 3p電子数が増加し、矢印②で示すように、吸収分光スペクトルが光エネルギーの高い側にずれ、金属から絶縁体に変わったことが分かりました。もし、水素原子とアルミニウム原子が完全なイオン結合であるならば、電気陰性度(注8)の違いから①とは逆の変化をすると予想でき、この実験結果から直ちにそれは否定されます。さらに、バンド計算(注9)を用いて、アルミニウム単体金属がアルミニウム水素化物になるとどのように電子状態が変化するのかを理論的に調べてみると、実験で観測された①と②の結果を定性的に説明できることも分かりました。このことから、アルミニウム水素化物においては、水素原子とアルミニウム原子が共通の電子を介して形成される共有結合で結合していることが明らかになりました。これまでの理論的研究だけでは決定に至らなかったアルミニウム水素化物における結合様式について、SPring-8を駆使した実験により決着をつけることができました。
本研究は、独立行政法人新エネルギー・産業技術総合開発機構(NEDO)の水素貯蔵材料先端基盤研究事業「水素と材料の相互作用の実験的解明」の委託を受け、試料育成から電子状態の測定、理論的検証に至るまで一貫した体制で実施しました。
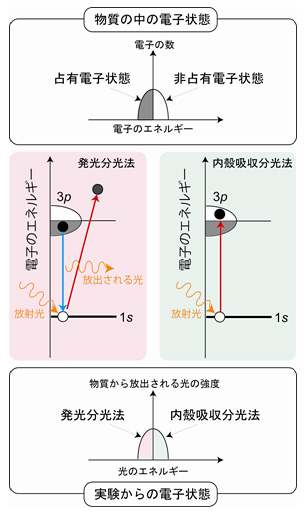
図3 発光分光法と内殻吸収分光法によるAl 3p電子状態の決定。吸収分光法の場合は、Al 1s内殻電子が放射光からエネルギーを吸収し、Al 3p電子の非占有電子状態に遷移する確率を調べます。発光分光法では、放射光のエネルギーを吸収してAl 1s内殻電子が抜けたところを占有電子状態にあったAl 3p電子が埋める確率を調べます。よって二つの実験を組み合わせると、Al 3p電子の占有および非占有電子状態の情報を得ることができます。
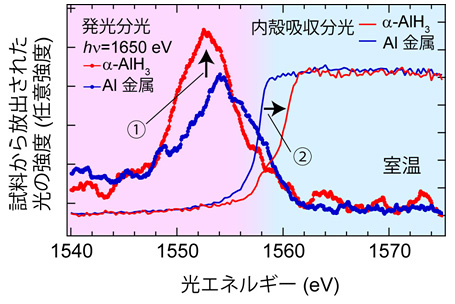
図4 アルミニウム単体金属(青色)とアルミニウム水素化物α-AlH3(赤色)の発光分光と内殻吸収分光実験から得られた電子状態の比較。発光分光実験(ピンクの部分)の横軸は、光エネルギー1650 eVの光を試料に照射したときに、試料から放出された光のエネルギーを表し、内殻吸収分光実験(ブルーの部分)の横軸は試料に照射した光のエネルギーを表しています。縦軸は、いずれの実験においても試料から放出された光の強度を表しています。両実験結果を組み合わせることにより、Al 3p電子の占有電子状態と非占有電子状態を得ています。
【成果の波及効果】
アルミニウム水素化物において、理論的研究だけでは決定できなかった水素原子とアルミニウム原子の結合様式について、初めて実験的な確証を得たことにより、アルミニウム水素化物の水素の貯蔵・放出のメカニズムの理解が進み、資源の豊富さと軽量さという強みを持ったアルミニウムを基盤とした新しい水素貯蔵材料の設計や性能向上の指針につながるものと期待できます。
この研究成果は、10月10日にPhysical Review B Brief Report84巻の153102ページに"Electronic structure of aluminum trihydride studied using soft x-ray emission and absorption spectroscopy"として掲載されました。
URL:http://link.aps.org/doi/10.1103/PhysRevB.84.153102



