研究の内容と意義
独立行政法人日本原子力研究開発機構、国立大学法人大阪大学、兵庫県立粒子線医療センター、財団法人電力中央研究所、日本アドバンストテクノロジー株式会社、株式会社新日本科学の共同研究グループは、レーザー駆動の原理で加速した陽子線を照射する装置を開発し、培養状態(in vitro)のヒト由来肺腺がん細胞株(A549)に対して照射し、がん細胞DNAの2本鎖切断が発生することを実証した。
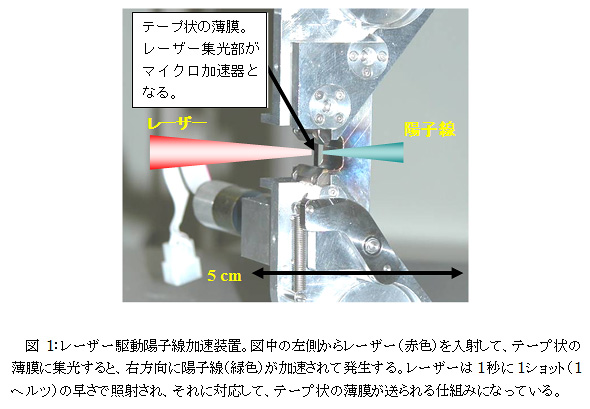
この装置では、原子力機構が開発した、高強度(>1018W/cm2)のレーザー光を数ミクロンの厚さの薄膜ターゲット上に集光することで高密度のプラズマを生成し、薄膜の裏面(レーザー集光面の逆側)へ向けて粒子を連続的に安定加速するテープ薄膜ターゲットが利用される(図1)。なお、この図のターゲットの数十ミクロンのレーザー集光スポットそのものが粒子加速器部分であり、原子力機構では、高強度レーザー装置(J-KAREN)を用いて、2008年度の時点で最大エネルギー5.4 MeVの陽子線加速に成功している。
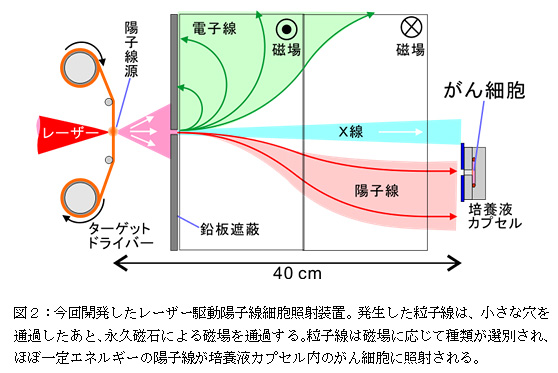
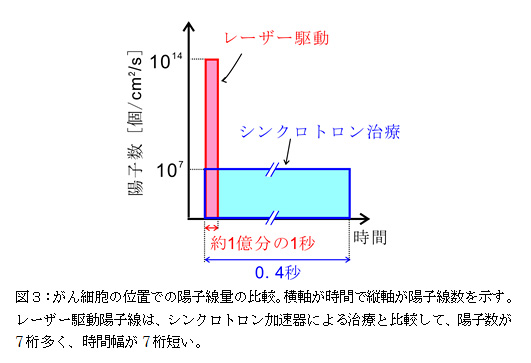
細胞照射実験では、図1で示した粒子加速部分の下流に、永久磁石を用いた小型の粒子線選別装置[図2]を設置することで、粒子と同時に発生するバックグラウンド放射線であるX線および電子線を除去している。そのため、がん細胞サンプルにはエネルギーを選別した陽子線のみが照射される。がん細胞サンプルとしてはヒト由来肺腺がん細胞株(A549)を使用した。細胞サンプルは細胞が生きた状態の培養状態(in vitro)のままカプセルに封入し、薄膜窓(材質:ポリイミド、厚さ12.5 μm)を介してほぼ一定エネルギーの陽子線のみが照射される。本実験装置における陽子数は単バンチ(レーザー1ショットで発生する粒子線)で、2.5×106 cm-2であった。また、バンチの時間幅は約1億分の1秒と測定された。この短い時間の間に、細胞核1つあたりに平均10個程度の陽子がほぼ同時に入射した計算になる。本実験装置で細胞に照射された陽子線の粒子数は、がん細胞の位置で約1014 個/cm2/sとなる。これを電流値に換算すると、ビームの直径を10 cmとして、約1 mAとなる。このレーザー駆動による陽子数を、従来のシンクロトロン加速器による治療でがん患部に照射される陽子線の粒子数と比較すると(図3)レーザー駆動陽子線は、陽子数が7桁多く、時間幅が7桁短いことになる。つまり、レーザー駆動では、シンクロトロン加速器の場合と同程度の陽子数を、約1億分の1秒の時間幅で集中的に照射していることになる。このよう高電流・短時間幅の陽子線を細胞に照射する実験は、今回のレーザー駆動陽子線細胞照射装置の開発によってはじめて可能となった。
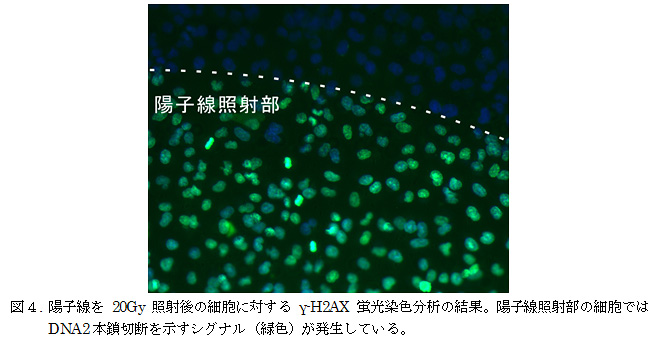
レーザー駆動陽子線の照射によってがん細胞のDNAに発生する損傷を評価するために、リン酸化ヒストン蛋白質6)(γ-H2AX)を用いてDNA2本鎖切断の生成を分析した。この分析方法は、がん細胞が2本鎖切断を修復しようとする際に作用する特有の物質に対してのみ蛍光マーカーをつけることで、DNA2本鎖切断の起こった場所を、視覚的に測定することのできる手法である。この手法を用いるためには、DNA2本鎖切断の修復活動が最も活発になる照射30分後に蛍光分析を行う必要がある。今回の実験で、レーザー駆動陽子線の照射後に、がん細胞を生きたまま取り出す技術が確立されたことで、DNA2本鎖切断の蛍光分析が可能となった。図4には、レーザー駆動陽子線を20 Gy照射した後の細胞を観察した顕微鏡画像を示す。ここでは、青色の蛍光を発しているがん細胞核のうち、陽子線の当たっている領域のがん細胞核が緑色の蛍光を示している。緑色の蛍光は、がん細胞核内のDNAに、放射線損傷の一種である、2本鎖切断が発生していることを示している。このDNA2本鎖切断は、2重らせん構造を形成しているDNAの両鎖に切断が生じる損傷であり、がん細胞を含む生物にとっては、最も修復が困難な損傷であるため、がん細胞死誘導の原因となる。この結果は、レーザー駆動によって発生した、高電流・短時間幅の陽子線が、従来の加速器による陽子線と同様に、がん治療効果を有することを示唆する結果である。なお、今回照射された陽子線の、がん細胞到達時における線エネルギー付与(LET)7)は20-30 keV/μmであったが、これは一般的に陽子線が最も高い生物学的効果比(RBE)8)を発揮する領域に一致している。