発表内容:
水は最も一般的な溶媒であり、各種の塩を溶かして水溶液を作ります。ところが、水分子の結晶である通常の氷(氷I相, 注1)と塩とは互いにほとんど固溶しません。このことはかなり古くから(おそらくは有史以前から経験的に)知られていたと思われます。しかし一方で、高圧下でできる他の多形の氷と塩との反応については、実際にそれらが存在する氷天体の構造モデルへの応用などに重要な情報であるにも関わらず、ほとんど何もわかっていないといっても過言ではない状況でした。
本研究の主著者であるパリ第6 ピエール・エ・マリ・キュリー大学のS. Klotz教授および同L.E. Bove研究員らは、2009年に、塩化リチウムが氷の高圧相である氷VII相中に高濃度に取り込まれうることを世界で初めて示しました[Klotz et al., Nature Materials, 8, 405-409, (2009)]。氷と塩とは互いに固溶しないという従来の常識を覆す大発見でしたが、その構造の詳細については未解決のままでした。
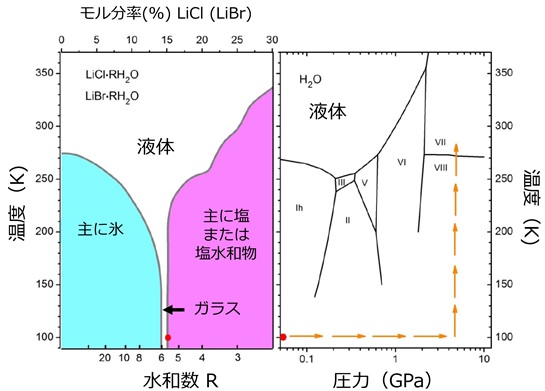
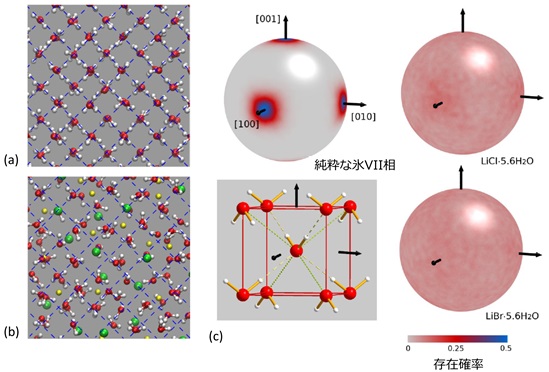
本研究では、塩化リチウムおよび臭化リチウム水溶液がガラス化(注2)する最大濃度である水和数5.6 (図1左, モル分率で15.2%)に調整した水溶液を出発試料に用いました。冷却→加圧→昇温というプロセスを経ることで、同濃度の塩をリチウムイオンおよび塩化物/臭化物イオンの形で取り込んだ氷を合成することに成功しました(図1右)。測定した中性子回折(注3)および分子動力学計算(注4)の結果から、本研究で得られた高濃度に塩を含む氷は、氷の高圧相である氷VII相に似た酸素配置を持つものの、水分子の向きについては氷VII相とは異なり、ほぼ等方的に分布していることが明らかとなりました(図2)。このように酸素の周期性を保ちながら分子の向きが等方的であるという例は、メタンやC60などの球に近い等方的な分子では「プラスチック相(注5)」として見られることがあります。しかし、そのようなプラスチック相は動的に分子が回転しているのに対し、塩を含む氷中の水分子は室温程度ではほぼ静止しており、純粋な氷中の水分子よりもむしろ回転頻度は低いことから、プラスチック相とは本質的に異なる状態であることが示唆されます。また、塩を含む氷中の水素結合ネットワークは、そのほとんどがリチウムイオンや塩化物/臭化物イオンによって破断されており(図2b)、他の多形の氷には見られない異常な状態と言えます。さらに、この塩を含む氷は、同条件における純粋な氷VII相に比べて最大18%も体積が大きく、低温下で常圧に減圧すると、最初に冷却して得られたガラスとは明らかに異なる状態のガラスが得られるなど、いくつもの興味深い特異性を持っていることが初めて明らかになりました。
(図2)分子動力学法によって得られた (a) 純粋な氷VII相および (b) 高濃度に塩を含む氷の構造。(c) 水分子の電荷の偏りの向き(双極子モーメント)を球面上の確率分布として示したもの。純粋な氷VII相(上)では、ある特定の方向に配向しているのに対し、高濃度に塩を含む氷(右上: LiCl 5.6H2O, 右下: LiBr 5.6H2O)では、ほぼ等確率で全方位に分布していることがわかる。
[研究の意義]
氷には数多くの多形が存在しますが、その全てが3次元的にほとんど切れ目のない水素結合ネットワークを有しています。また、一般的に物質中の水素結合の向きは結晶中で特定の方向を向くことがほとんどです。今回初めて発見された壊れた水素結合ネットワークや等方的な水分子の配向によって、塩を高濃度に含む氷は、他の物質にはない新奇な物性を発現する可能性があります。また本研究は、極端に膨張した体積や複数のガラス状態との相転移など、氷の新たな特異性を複数提示している点で、今後の氷研究、ひいては物性科学や惑星科学などの広範囲の研究に多くのインスピレーションを与えることが予想されます。
発表雑誌:
雑誌名:「Scientific Reports」(オンライン版の場合:8月26日)
論文タイトル:Ice VII from aqueous salt solutions: From a glass to a crystal with broken H-bonds
著者:S. Klotz, K. Komatsu, F. Pietrucci, H. Kagi, A.A. Ludl, S. Machida, T. Hattori, A. Sano-Furukawa, L.E. Bove