【研究の背景】
生体では、細胞の表面に様々なタンパク質が存在し、細胞の外側で特定の分子と作用することにより、生命現象に関わる様々な信号を細胞の内側に伝えます。このように信号を「受け取る」役割を持つこれらのタンパク質のことを「受容体」と呼びます。がん(腫瘍)細胞の細胞死(アポトーシス)を引き起こす働きをする受容体の1つとして、「腫瘍壊死因子関連アポトーシス誘導リガンド受容体(TRAIL-R2)」が知られています。この信号はがん細胞においてのみ伝わることから、TRAIL-R2を標的とした抗がん剤の開発がさかんに行われています。そのうちの1つがKMTR2と呼ばれる抗体(タンパク質の1種)で、この信号をがん細胞に伝えます。
これまで原子力機構の玉田太郎グループリーダーらは、KMTR2の働きを様々な手法で調べてきました。その結果、KMTR2が、ヒトが持つTRAIL-R2(ヒトTRAIL-R2)を数多く会合させることで細胞死の信号を伝えることを明らかにしました。しかしながら、KMTR2がどのような会合状態でヒトTRAIL-R2に作用し、細胞死の信号を伝えるかは全くわかっていませんでした。
そこで、研究グループは、KMTR2とヒトTRAIL-R2が結合した状態でX線結晶構造解析することで、KMTR2が細胞死を引き起こすメカニズムを明らかにすることを試みました。
【研究の内容と着想ポイント】
KMTR2のヒトTRAIL-R2の反応に関わる部分を抜き出して、2つのタンパク質が1:1で結合する複合体(以下、1:1複合体)の結晶を作製しました。得られた結晶に大型放射光施設(SPring-8)の強力なX線を照射し、2.1Å分解能(1オングストロームは100億分の1メートル)という高い分解能(解像度)でその三次元立体構造を決定しました。その結果、KMTR2がヒトTRAIL-R2に結合している様子を詳細に明らかにすることができましたが、この情報だけではKMTR2がどのようにヒトTRAIL-R2を会合し、細胞死の信号を伝えるかを解明することはできませんでした。
タンパク質は3次元的に規則正しく配列することにより結晶状態を形成しますが、結晶中の規則性に基づいた構造がタンパク質の機能に重要であることを、研究グループはこれまでに実施した研究において実証した実績がありました。そこで、本研究では結晶中の規則性に着目し、1:1複合体は隣の複合体とKMTR2中の軽鎖間を認識し合うことにより2量体(2:2複合体)を形成(図1)しており、この2:2複合体がヒトTRAIL-R2の会合構造の基本単位になっていると考え、その実証を試みました。
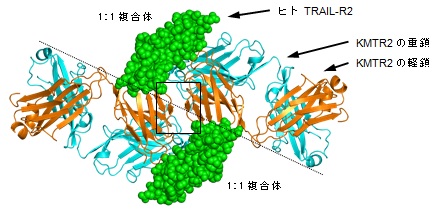
図1. 結晶中に見出したメカニズムの「鍵」となる基本単位
がん細胞に特異的に細胞死を誘導する抗体(KMTR2)の抗原認識を担う重鎖と軽鎖からなるFab領域とヒト受容体(TRAIL-R2)の細胞外に存在する領域の1:1複合体が、結晶中の規則性に基づいて点線を境に向き合って2量体(2:2複合体構造)を形成している。KMTR2の重鎖を水色、軽鎖を橙色、ヒトTRAIL-R2を緑色で示している。図2として拡大する箇所を四角で囲んでいる。
【着想の実証結果】
2:2複合体は隣り合ったKMTR2軽鎖中のアスパラギン(Asn53)というアミノ酸とアルギニン(Arg54)というアミノ酸が認識しあうことで形成されていました(図1右)。このため、この認識を解消すれば2:2複合体の会合構造は形成されないと考え、Asn53をプラスの電荷を有し、かつ嵩高いアミノ酸であるアルギニン(Arg53)に置換した変異体(LkN53R)を作製しました。
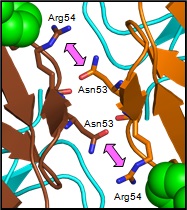
図2. 2:2複合体形成に重要な抗体間の認識
(図1の四角内の拡大図)
KMTR2軽鎖中のAsn53とArg54がお互いに認識しあっている(矢印)。Asn53をアルギニンに置換することで、この認識は解消されると仮定。表示の色は図1と同じであるが、KMTR2の軽鎖は橙色(右)と茶色(左)で隣の分子を区別した。
複合体の会合状態をゲルろ過クロマトグラム(分子量の大きさを解析できる手法)で確認したところ、Asn53を有する状態のKMTR2では分子量が高い複合体が多く存在しているのに対し、Arg53に置換した後のLkN53Rはそのような複合体は解消されていました(図3)。
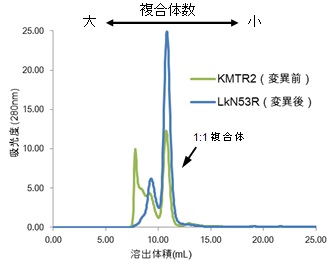
図3. KMTR2とその変異体(LkN53R)によるヒトTRAIL-R2複合体状態の変化
分子量が大きいほど、早い溶出体積で観察される。KMTR2軽鎖のアスパラギン(Asn53)をアルギニン(Arg53)に変えることによって、複合体の会合状態(変異前:緑、変異後:青)が「大」から「小」へと大きく変化していることがわかる。
得られた複合体の結合がどの程度であるかを評価した結果、LkN53RのヒトTRAIL-R2への結合の強さはKMTR2とほとんど変わりがないことがわかりました(図4左)。一方で、がん細胞がどの程度死滅しているかを確認したところ、両者の間で大きく違いがありました(図4右)。これにより、KMTR2中の軽鎖間を認識し合うことにより形成された2:2複合体がヒトTRAIL-R2の会合構造の基本単位になって、がん細胞を死滅することを実証しました。
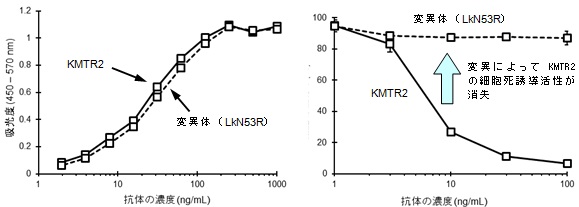
図4. KMTR2とその変異体(LkN53R)の活性の比較
ヒトTRAIL-R2に対する結合活性(左)とがん細胞の細胞死誘導活性(右)。
左の図では、抗体濃度が高くなるにつれてKMTR2と変異体LkN53Rの曲線が同じように変化していることから、結合の強さに差が無いことが分かる。
一方、右の図では、抗体の濃度に応じてKMTR2では細胞の生存率が減少しているのに対し、変異体LkN53Rでは濃度を高くしても生存率が下がらないことから、変異導入によってがん細胞の細胞死を誘導する活性が消えていること(矢印の変化)を実証した。
【研究の成果と今後の期待】
X線結晶構造解析により取得した立体構造情報と、それに基づいて作製した変異体を用いた検証を組み合わせることにより、結晶中に見出したKMTR2(Fab領域)とヒトTRAIL-R2(細胞外領域)の2:2複合体を基本単位として、ヒトTRAIL-R2の高度な会合(複数の分子が一定の決まりで結びついた状態)が形成され、KMTR2によるがん細胞の細胞死が引き起こされるという作用メカニズムを原子レベルで初めて明らかにしました(図5)。
抗体分子は相手分子(抗原)を特異性高く認識するという特性があることから、特定の分子を標的とした療法(分子標的治療)に幅広く用いられています。がん治療においても、副作用の少ない医薬品として数多くの抗体分子が医薬品として臨床応用されています。今回の研究において、原子レベルで明らかにしたKMTR2の作用メカニズムは、より高機能な抗体分子の創製に繋がる知見を含んでおり、より効果の高い抗がん剤の開発に繋がることが期待されます。
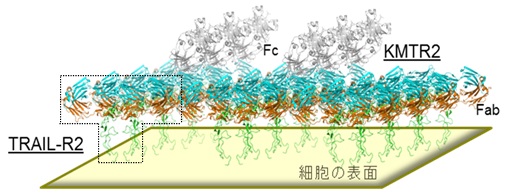
図5. 本研究で解明に成功した、細胞表面におけるKMTR2によるヒトTRAIL-R2の高度な会合状態(モデル図)
図1で示した2:2複合体(点線部分)を結晶中の規則性に基づいて平面的に複数並べたモデル図。2:2複合体を作用の「鍵」となる基本構造として高度な会合状態を形成する。表示の色は図1と同じであるが反応に直接かかわらない部分は灰色で表示。