【実験の概要】
HIV-1プロテアーゼとその阻害剤KNI-272との複合体の中性子結晶構造解析には、原子力機構が東海研究開発センター原子力科学研究所(茨城県東海村)の研究用原子炉(JRR-3)に設置した生体高分子用中性子回折計装置BIX-44)を用いました。得られたデータを解析することによってHIV-1プロテアーゼの全原子構造(図1)を決定することに成功しました。
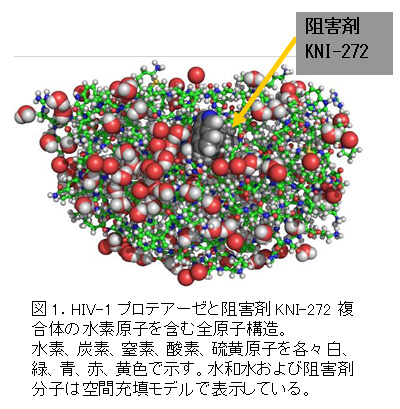
ヒト免疫不全ウイルス(HIV)の感染者は、世界に4000万人以上いると推定されています。免疫細胞に感染したHIVは、免疫細胞を破壊して後天性免疫不全症候群(エイズ)を引き起こします。HIV-1プロテアーゼは、HIVの増殖に必須のタンパク質で、その作用を阻害する分子(阻害剤)は、抗エイズ薬の重要な候補となります。より効果的な抗エイズ薬開発を目指して、水素や水和水の情報を含むHIV-1プロテアーゼの全原子構造情報が求められていました。しかしタンパク質の主要構成元素の一つである水素原子の観測は大変難しいことが知られています。そこで研究グループは、水素原子の観測を得意とする中性子を用いて、HIV-1プロテアーゼとその阻害剤であるKNI-2722)との結晶構造解析(中性子結晶構造解析3))を行いました。
HIV-1プロテアーゼは、2つのアスパラギン酸(Asp25とAsp125)を触媒残基5)とするタンパク質分解酵素であり、HIVの増殖に必須であることが知られています。従って、HIV-1プロテアーゼの触媒機構及びその阻害剤との相互作用様式の解明が、抗エイズ薬(阻害剤)開発への重要な知見となります。HIV-1プロテアーゼの立体構造は、これまでにもX線結晶構造解析による解析例が多数報告されています。しかしX線は水素原子の検出に対して感度が低いため、機能発現に重要な水素原子は観察されていませんでした。そこで研究グループは、水素(重水素)原子の検出に対して感度の高い中性子結晶構造解析を実施しました。
HIV-1プロテアーゼとその阻害剤KNI-272との複合体の中性子結晶構造解析には、原子力機構が東海研究開発センター原子力科学研究所(茨城県東海村)の研究用原子炉(JRR-3)に設置した生体高分子用中性子回折計装置BIX-44)を用いました。得られたデータを解析することによってHIV-1プロテアーゼの全原子構造(図1)を決定することに成功しました。

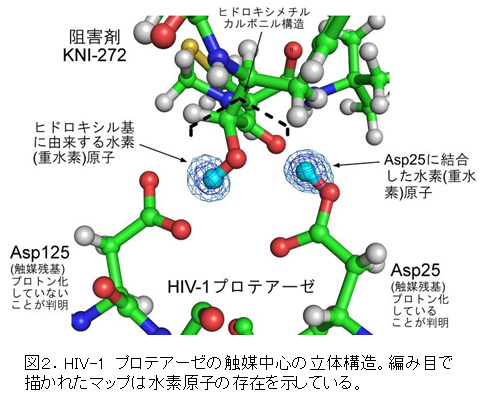
今回用いた阻害剤KNI-272は、その中心にヒドロキシメチルカルボニルという特徴的な構造を持ち、HIV-1プロテアーゼの触媒残基と相互作用しています。触媒残基であるAsp25がプロトン化した状態で阻害剤KNI-272のカルボニル基と水素結合を形成し、阻害剤KNI-272のヒドロキシル基がプロトン化されていないAsp125と水素結合を形成することが明らかになりました(図2)。
また、HIV-1プロテアーゼの触媒機構については、複数の説が提唱されていましたが、今回の結果からAsp25が基質となるペプチドにプロトンを供与すると同時にAsp125が加水分解に使われる水分子の活性化によって触媒反応が進行することがわかりました。
以上のように、HIV-1プロテアーゼの中性子結晶構造解析により、活性部位に存在する触媒残基(はさみ)の正確な水素原子の位置情報と触媒残基の荷電状態などの具体的な特徴を利用して、ウィルスに対する薬剤(阻害剤)を精密に設計することが可能になりました。
なお、今回の解析では、試料の水素原子の一部を重水素原子に置き換えて測定しました。重水素原子は水素原子の安定同位体の一つであり、化学的な性質は水素原子と比較してよく似ています。図2に示す2つのマップは重水素原子の観察結果であり、水素原子の存在を示しています。
本研究で得られたHIV-1プロテアーゼの全原子構造、触媒機構及び阻害剤KNI-272との詳細な相互作用様式に関する知見は、さらに高活性のHIV-1プロテアーゼ阻害剤の開発に繋がるものと期待されます。研究グループはより高活性の抗エイズ薬開発に引続き取り組んでいます。
本研究は、原子力機構、京都薬科大学、大阪大学及び(株)創晶の4機関が共同して実施しました。原子力機構は主にHIV-1プロテアーゼの試料調製と中性子を用いた構造解析、京都薬科大学は阻害剤の設計・合成、大阪大学及び(株)創晶は中性子回折実験用の大型結晶作製を担当しました。